用于心血管生命体征监测的柔性可穿戴传感器 --知识铺
文章链接:https://doi.org/10.1002/adhm.202100116

摘要:心血管疾病是全球死亡率最高的疾病,但可穿戴技术的最新进展可能会改变这些疾病的诊断和管理方式。特别是,非常需要对心血管生命体征进行连续监测,以便进行早期干预。为此,可以长时间舒适佩戴的柔性可佩戴传感器正受到极大关注。在这篇综述中,概述并讨论了用于监测心血管生命信号的先进柔性可穿戴传感器。具体而言,重点介绍了这些用于心率、血压、血氧饱和度和血糖监测的柔性传感器的功能材料、配置、机制和最新进展。介绍了生物电、机电、光电和超声波可穿戴传感器的不同机制,以从不同身体位置监测心血管生命体征。本文还讨论了这些可穿戴传感器目前面临的挑战、可能的策略和未来的发展方向。随着快速发展,这些柔性可穿戴传感器将有可能应用于医疗诊断和日常医疗保健,以应对心血管疾病。
1 介绍
心血管疾病每年导致超过1700万人死亡,占全球死亡人数的31%。到2030年,这一数字预计将增加到2360万。仅在美国,每年至少有140000人死于心血管疾病,每4分钟就有一人死于心血管疾病。尽管死亡率很高,但90%的心血管疾病可以通过早期检测来预防。因此,持续和实时的心血管监测对于降低心血管疾病的发病率和死亡率至关重要。
尽管基于血压测量的心血管疾病传统诊断,24小时心电图监测和核磁共振成像是有效的,但它们有各种局限性。基于袖带的血压测量只能间歇性地测量收缩压和舒张压,这可能不足以完全反映心血管状态。24小时心电图设备(Holter monitor)需要将多个电极连接到患者的胸部,并通过电线连接到记录系统,这种设备体积庞大且容易意外断开。或者,核磁共振成像可以直接和精确地确定堵塞的位置。然而,它昂贵、复杂,并且可能含有放射性物质。更重要的是,这些心血管评估工具通常是在医院中实施的,因此很难对心血管的长期状态进行实时监控。为了在不干扰日常活动的情况下连续、无创地监控这些信号,需要灵活的可穿戴传感器。由于心血管疾病的预防和管理在日益老龄化的人口中起着至关重要的作用,柔性可穿戴传感器在医疗保健领域具有特殊的潜力和意义。因此,用于心血管生命体征监测的柔性可穿戴传感器最近引起了人们的极大兴趣,并得到了广泛的研究。
在这里,我们回顾了柔性可穿戴传感器的最新进展,这些传感器可以连续、无创地监测心血管生命体征,包括心率、血压、血氧饱和度和血糖。具体来说,我们从材料、机制、设备和医疗应用的角度阐述了每一类可穿戴心血管传感器。举例说明了构成该器件并赋予其柔韧性、耐磨性和透气性的功能材料。还包括用于监测这些生命体征的传感器的机制、配置、进步、优点和缺点。最后,概述了当前的挑战,可能的战略和未来的方向。

2 用于心血管生命体征监测的柔性可穿戴传感器综述
心血管生命体征,包括心率(HR)、血压(BP)、血氧饱和度(SO2)和血糖,临床医生经常使用这些来评估患者与其心血管系统相关的生命维持功能。图1显示了心血管生命体征的概况以及用于无创监测这些信号的柔性可穿戴传感器的分类。根据不同的机制,所使用的柔性可穿戴传感器可以分为五类——生物电、光电、机电(压力和应变)、超声波和电化学传感器。
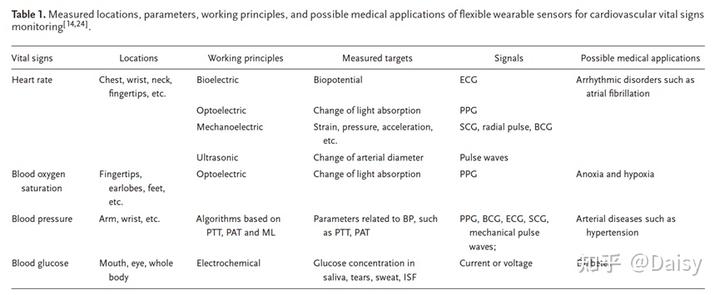
表1总结了这些生命体征的测量参数、工作原理、检测部位和可能的医学应用。具体而言,这些心血管生命体征可通过以下机制在不同位置进行测量:1)心率可通过生物电、光电、机电、超声技术获得,这些技术基于ECG的脉动波形、光电容积描记法(PPG)、心震描记法(SCG)和心冲击描记法(BCG)、径向脉冲波形和超声波描记法。根据所使用的技术,可以在胸部、指尖、颈部和手腕的不同位置记录这些信号;2)血氧饱和度可通过PPG在手指、耳垂或足部皮下动脉位置较浅的位置进行监测;3)持续血压是通常基于来自生物电、光电、机电传感器的信号,通过基于脉冲瞬时时间(PTT)或脉冲相对时间(PAT)的算法和机器学习(ML)算法来估计;4)血糖由电化学传感器通过唾液、眼泪、汗液和间质液(ISF)进行测量。
通常,用于心血管生命体征监测的柔性可穿戴传感器包括三个主要部件:基板、电极和感测有源部件,如图2所示。为了使这些传感器具有耐磨性和灵活性,需要考虑每种元素具有独特的机械、物理化学和生物特性的材料。
3.1 基底材料
由于柔性、可伸缩性、重量轻和低成本的优点,聚合物膜或织物经常被用作柔性可穿戴传感器的基底。制成塑料薄膜的聚酯(PET)、聚酰亚胺(PI)、聚醚酰亚胺(PEI)、聚丙烯或聚萘二甲酸乙二醇酯(PEN)都是良好的候选材料,因为它们在弯曲、折叠或起皱时具有优异的机械性能。基于微米厚的超薄塑料衬底的概念,Takao Someya的小组报告了在难以察觉的塑料电子器件方面的突破,包括传感器、晶体管和太阳能电池。例如,Lee等人在总厚度为2μm的1.4μm厚的PET衬底上制作了一个弯曲不敏感的压力传感器,即使在极端弯曲和软接触条件下,也可以独立于机械应力测量法向压力。他们还报告了一个2.6μm厚的超柔性多电极阵列,由有机电化学晶体管制成,位于1.2μm厚的聚对二甲苯基板上,可对跳动的心脏进行长期ECG监测,不会因高达15%的拉伸应变和保形接触而滑动和分离。尽管基于塑料的可穿戴传感器具有更高的机械和电气稳定性和鲁棒性,但它们在延展性方面存在局限性。相比之下,诸如聚二甲基硅氧烷(PDMS)、Ecoflex、热塑性聚氨酯(TPU)和苯乙烯-乙烯-丁烯-苯乙烯(SEBS)等固有可拉伸弹性体更具吸引力。基于弹性体基底,Zhenan Bao的小组提出了电子皮肤(e-skin),它不仅灵活,而且可以模仿皮肤的伸展性和柔软性。例如,Wang等人报道了一种可拉伸的聚合物晶体管阵列,其在衬底上具有前所未有的每平方厘米347个晶体管的器件密度,可拉伸至100%应变。他们还报道了一种基于PDMS-MPU0.4-IU0.6基底的可拉伸和自愈的电子皮肤,可拉伸至1600%应变。由于纳米结构银纳米线(AgNW)或碳纳米管(CNT)网络的动态重构以及基底的自愈合和拉伸能力,所制造的电致发光皮肤、ECG传感器和应变传感器可以承受高达100%的应变而不电击穿,并且即使在损坏后也可以自愈合。尽管基于弹性体的可穿戴传感器具有可拉伸性、柔软性甚至自愈性等吸引人的优点,但由于老化、滞后和某些橡胶链在剧烈拉伸下的断裂,它们在循环应变下的电稳定性仍然具有挑战性。此外,基于塑料和弹性体的可穿戴传感器在渗透性方面都有局限性,这会导致不适和对皮肤的不良粘附。相比之下,由天然或合成聚合物制成的织物,如棉、丝、Nomex、Kevlar和尼龙,具有良好的柔韧性和透气性,是很好的选择。通过将功能性材料涂覆到纤维上或将功能性纤维缝合到织物基底中或织物基底上,电子纺织品(e-textile)被提出并被广泛设想。值得注意的是,硅,作为传统刚性微电子器件中使用的衬底,如果足够薄,也可以用作柔性电子器件的衬底。
3.2 电极和互连材料
目前,柔性可穿戴电子设备的电极和互连通常由固体金属、导电聚合物、碳和基于液态金属的导体制成。固体金属天然坚硬。为了使它们具有灵活性,采用了蛇形、分形和kirigami结构形式的超薄带和细丝的确定性构型。这种技术的优点是与传统的微纳制造工艺兼容和具有高导电性。其局限性在于复杂的制造工艺和受其几何形状和固体材料特性限制的可拉伸性。导电聚合物被认为是有前途的候选材料。事实上,没有添加或改性的传统导电聚合物是固有刚性的,具有约5%的低拉伸性。为了获得柔韧性甚至可拉伸性,已经采用了诸如添加非离子和离子小分子以及与弹性体或水凝胶结合的策略。碳和金属纳米/微米颗粒,以碳纳米管、石墨烯颗粒、金属纳米/微米板和金属纳米/微米线的形式,通常是刚性的和非连接的。为了制造柔性导电迹线,通常将它们分散在弹性体中以形成导电的渗透网络。这种技术的吸引力在于纳米/微米导电颗粒和聚合物的复合物可以制成导电墨水,然后可以基于3D或丝网印刷方法以非常低的成本将其图案化成各种复杂的轨迹。这种方法的缺点是,由于包含不导电的聚合物,电导率不如大块金属高。另外,由于刚性填料的存在,复合材料的机械性能不如聚合物。相比之下,高导电性和高流动性的液态金属被认为是形成高性能柔性导体的有前途的材料,当与聚合物或弹性体结合时,不会损害导电性或机械性能。此外,由液态金属和聚合物制成的复合材料可以以低成本制造用于印刷的墨水。关于柔性电极和互连的更多信息,可以参考几篇综述。
3.3 传感活性组分材料
传感有源元件的材料根据工作原理而变化。柔性可穿戴生物电传感器主要基于柔性导体,上面已经在电极和互连中说明了这些导体。在柔性可磨损机电传感器中,基于所利用的转换机制,传感活性材料的范围从导体和半导体到电介质。通常,电阻性、电介质、压电和摩擦电材料用于感测有源部件。柔性可穿戴光电探测器基于用于心血管监测的光电技术,利用活性材料,如硫酸铅(PbS)量子点、聚(3-己基噻吩)(P3HT):[6,6] -苯基C61-丁酸甲酯(PCBM)混合物或钙钛矿。然而,一些传感活性材料在折叠、起皱和拉伸时并不稳定。尽管已经利用了一些预拉伸策略,但是抑制弯曲或拉伸过程中的性能恶化仍然具有挑战性。
3.4 生物适应性
为了使传感器贴合皮肤而不产生副作用(例如无毒、无害或无刺激性),需要考虑生物相容性材料。生物相容的柔性聚合物,如PDMS、聚己内酯和聚甲基丙烯酸甲酯,通常用于柔性可穿戴传感器。例如,PDMS已用于植入式人工心脏瓣膜,因此被选为可穿戴电子产品的基底。其它选择包括聚己内酯,它在临床上被用作可再吸收的合成缝合线、螺栓和骨板。还报道了生物相容性绝缘聚合物,如聚乙烯醇(PVA)、聚乳酸(PLA)、聚己内酯(PCL)、聚癸二酸甘油酯(PGS)、聚乙二醇(PEG)和聚乳酸乙醇酸(PLGA)。就电极和互连而言,金因其惰性而成为常用材料。据报道,新兴的导电聚合物如聚(3,4-乙撑二氧噻吩)(PEDOT)、聚吡咯(PPY)和聚苯胺(PANI)也是相容的。对于感测活性成分,由于其通常不直接接触皮肤,且通常被基底封装,因此对其相容性的关注较少。由于传感活性组分对传感性能有着至关重要的影响,因此在选择传感活性组分时应考虑性能和生物相容性之间的权衡。
3.5 气体渗透性或透气性
为了舒适、连续地监测心血管生命体征,还需要透气性,以便水分能够透过柔性传感器。如果没有透气性,汗腺导管可能会被该器件堵塞,从而可能导致皮肤炎症或刺激。此外,汗水可能会影响皮肤和设备之间的紧密接触。为了赋予气体渗透性,已经展示了一些可拉伸的聚合物,其长链之间的孔大于小气体分子。然而,水的渗透性低于10-12m2·Pa-1·S-1。然而,可穿戴纺织品的透气性(由水蒸气透过率确定)可以达到12.5kg·m2·d-1。为了满足透气性的要求,基于具有更高渗透性的网状和多孔薄膜或织物的柔性可穿戴传感器得到了广泛的研究。
4 柔性可穿戴传感器的传感机制
4.1 基于光电技术的PPG传感器
4.1.1 PPG传感器的工作原理
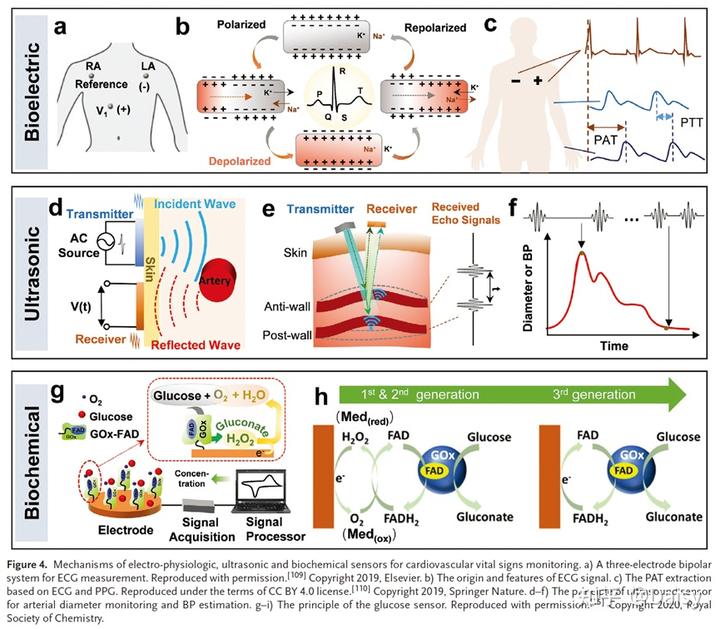
用于心血管生命体征监测的光电传感器,称为PPG传感器,通常以透射或反射方式工作选项模式(图3a,b)。PPG传感器由至少一对发光二极管(LED)和光电检测器(PD)组成,其中LED作为光源照射皮肤,PD检测剩余的透射或反射光(入射光的另一部分在穿透过程中被血液和组织吸收)。由于心脏活动期间脉动动脉中的血容量变化,PD检测到的透射光或反射光的强度会随着动脉脉动而变化(图3c),随后PD会将其转换为电信号。PPG信号(图3c)包含交流(AC)分量和直流(DC)分量,这两个分量分别由脉动血液和非脉动组织的光吸收产生。基于PPG信号,可以获得心率、血氧饱和度和血压。
4.1.2 用于心率和血压监测的PPG传感器的机理
心率通过每分钟心跳次数(bpm)计算,可通过以下等式估算:HR = 60/T(bpm) (1)
其中T是一个完整心动周期的周期。另一种替代方法是使用快速傅立叶变换(FFT)分析,其中峰值的频率对应于心跳与基于PPG的心率采集只需要一个PPG信号不同,血压采集需要PPG传感器与其他生物电或机电传感器的集成。通过提取与血压相关的参数(例如来自多个信号的PTT和PAT)并使用算法(例如机器学习)以及基于标准血压测量的校准过程,可以获得连续的血压。
4.1.3 PPG传感器监测血氧饱和度的机理
用于SO2监测的PPG传感器的基础是氧合血红蛋白(HbO2)和脱氧血红蛋白(Hb)在特定波长的光吸收特性之间的差异。为了测量血氧饱和度,需要两个或多个不同波长的发光二极管发出的光。通常选择绿光(≈492–577nm)、红光(≈622–760nm)和红外光(IR,≈800–1000nm),因为HbO2和Hb的摩尔消光系数在绿光和红外光波长几乎相似,但在红光波长不同,如图3d所示。如果选择发射红光和绿光的两个发光二极管,根据比尔-朗伯定律,动脉血中HbO2和Hb引起的红光吸收(Ar)和绿光吸收(Ag)可由以下方程表示。

同样,红外光和红光也可以用于血氧饱和度的计算。
4.2 基于机电技术的SCG、BCG和脉搏传感器
4.2.1 机电传感器的工作原理
基于机电技术的用于心血管生命体征监测的柔性可穿戴传感器主要是应变和压力传感器。特别是,应变和压力传感器可以分为几类:电阻式、电容式、压电式和摩擦电式传感器(图3e–h)。尽管机制不同,但它们的配置通常相似,都由夹在两个电极之间的有源传感元件组成。类似地,对于所有这些传感器,有源传感元件响应于应变或压力而改变,导致电阻、电容或电输出的变化。虽然电阻式和电容式传感器需要外部电源进行感测,但自供电压电和摩擦电传感器可以直接将压力或应变转换为电信号。此外,电阻传感器的有源传感元件由导电网络制成,其中拉伸或挤压时的电阻变化源于几何变化、裂纹扩展、断开机制等。而对于电容、压电和摩擦电传感器,传感有源元件通常是双电学,其影响压力或应变的几何变化导致电容和转移电荷的变化。
4.2.2 用于心率/血压监测的机电传感器的机理
基于柔性压力和应变传感器、机电信号包括动脉脉搏波和SCG信号可以被获得。根据张力测定法,基于桡动脉或颈动脉的局部振动来测量脉搏波方法(图3i),其中传感器直接压在动脉上方的皮肤上。SCG是对胸壁局部振动的测量,这种振动是由包括心肌收缩、心脏瓣膜运动、血流紊乱等心脏机械运动引起的,使其广泛应用于可穿戴设备中(图3j)。此外,局部运动,全身质心也在每次心跳时轻微运动。BCG测量由以下因素引起的纵向或横向身体微动,身体维持整体动量的反冲力(图3k)。但是,经常需要用椅子、床或磅秤记录BCG信号,使其不太适合可穿戴应用。因此,SCG和动脉脉搏信号通常用于可穿戴式心血管生命体征监测。类似于PPG信号,上述机械信号也可以提供类似算法的心跳、血压参数。

4.3 基于生物电技术的心电传感器
4.3.1 心电图传感器的工作原理
心电图是通过放置在皮肤上的电极记录心脏电活动的信号。为了准确的临床诊断,通常使用10个电极的12个导联,用于从不同的心肌获得电活动。有时,也采用三个导联(图4a)。在这两种配置中,每条导联代表特定角度的ECG信号,通过记录两个位置的两个电极之间的生物电势来测量每个信号。ECG信号中的心动周期特征通常由三种波形组成(图4b): P波、QRS复合波和T波。P波代表心房去极化,对应于心房收缩;QRS复合体代表心室去极化和心室收缩;T波表明心室复极化和心室舒张。另一种波,即U波(浦肯野复极化),并不总是可见的。心脏的电活动是由心肌细胞的去极化和复极化引起的。在静止状态下,即相对于外部向内和向外的极化状态,细胞内部有过量的钾离子(K+),外部有过量的钠离子(Na+)。当心肌收缩时,细胞膜透性改变,Na+进入,K+退出,因此细胞去极化(图4b)。
4.3.2 心电传感器监测心率/血压的机理
临床上通常使用ECG来获得基于等式(1)或FFT技术的心率参数。由于心率与血压呈正相关,血压也可以仅从基于机器学习算法的心电图信号中得出。此外,一个更流行的方法是将ECG传感器与PPG传感器集成以获得用于连续血压估计的PAT。虽然PAT和PTT经常互换使用,但PAT被认为是心脏电活动(通常使用ECG)和沿动脉树向下测量的外周搏动(通常使用PPG)之间的时间延迟。相比之下,PTT是脉搏波(通常使用PPG或机电传感器)从相对近端位置(例如手臂)传播到远端位置(例如手指)或在两个远端位置(例如手指和脚趾)之间传播所用的时间,如图4c所示。尽管存在差异,PTT和PAT均与血压密切相关,可通过以下公式用于血压估算:
BP = A×ln(∆t) + B (8)
BP = A/∆t2 + B (9)
其中,∆t是时间延迟,可以是PTT或PAT。A和B是需要校准的受试者特定常数。
4.4 基于超声波技术的传感器
4.4.1 超声波传感器的工作原理
超声波检查利用压电薄膜产生的高频超声波来测量或检查体内结构或器官。在用于获得动脉超声检查的超声波传感器中,使用简单的脉冲回波技术来记录动脉直径,其中由压电换能器产生的超声波束被传输到体内,并检测从探头下的结构反射的回波(图4d,e)。通过分析动脉前壁和后壁回声峰值最高点之间的飞行时间,并将其与生物组织中的声速结合,可以计算出直径(图4e,f)。这种方法特别适用于监测深层动脉,因为超声波束是准直的且穿透很深。
4.4.2 用于心率/血压监测的超声波传感器的机理
基于高频超声波发射和接收,超声波传感器能够连续记录脉动血管的直径。因此,可以连续获得脉冲波形。心率可通过类似于心电图或PPG的方法连续估算。根据血管直径d(t)和血压P(t)之间的关系,可通过以下公式估算血压:

其中P(t)和d(t)分别是在任何时间t的血压和目标动脉的直径,Pd和Ps分别是舒张期压力和收缩期压力,它们需要通过标准的商用BP袖带来测量。Ad和As分别是舒张期和收缩期动脉横截面积,其可以由超声设备基于横截面积和动脉直径之间的关系来测量。
4.5 基于生化技术的葡萄糖传感器
用于血糖监测的柔性可佩戴葡萄糖传感器的机理通常基于电化学反应,由于葡萄糖氧化酶(GOx)在不同pH和温度条件下的高选择性和稳定性,其通常由葡萄糖氧化酶催化。在电化学过程中,通过信号采集装置检测与血糖浓度相关的电流或电压。在信号处理器的进一步协助下,采集的输出信号将被处理为伏安特征(CVs)曲线,用于关联和分析葡萄糖浓度(图4g)。对于第一代GOx电极传感器,葡萄糖被氧化为葡萄糖酸,O2被还原为过氧化氢(H2O2),过氧化氢将在电极表面被进一步电化学氧化以产生电子,形成可被信号采集平台检测到的安培电流(图4g)。电化学过程如下:
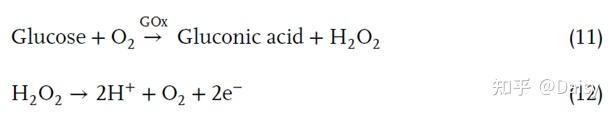
然而,在监测过程中,副作用(如抗坏血酸、乙酰氨基酚、尿酸和乳酸的氧化)可能会损害选择性。因此,推出了第二代基于GOx的传感器。在氧化还原反应中,介体在电极表面发生反应,产生直接穿梭到活性电极的电子,不仅可以摆脱对H2O2和O2的依赖,而且可以提高灵敏度和选择性(图4h)。然而,大多数介体的浸出问题和毒性极大地限制了它们在体内或连续监测应用中的应用。因此,葡萄糖生物传感器已经发展到第三代,通过设计酶和纳米结构电极的结构来缩小黄素腺嘌呤二核苷酸(FAD酶的亚单位)和电极,用于加速直接电子转移过程,从而优化电化学反应的性能。这种改进可以使生物传感器摆脱介质或氧气的限制,并直接促进GOx和电极之间的电子转移,以实现更快的响应速度和更高的灵敏度(图4h)。
5 用于心率监测的高级柔性可穿戴传感器
心脏通过有节奏的心脏活动在全身循环氧气和营养,这极大地影响了身体的整体功能。心率对心脏的功能至关重要心脏,作为心脏输出量,主要由心率和每搏输出量(心脏每次跳动泵出的血液量)决定。心率受到年龄、激素、自动神经支配和健康水平的影响。通常,健康成人的心率为每分钟60-100次。低于60 bpm或高于120 bpm,可能会出现心脏疾病,如心动过缓和心动过速。基于等式(1)或FFT分析,不同的模式(例如生物电、光电、机电和超声波方法)可用于心率测量。
5.1 生物电技术
基于ECG传感器的生物电方法在临床中广泛用于获得心率。所获得的ECG信号包含有价值的信息,用于诊断心脏疾病,例如心房纤维性颤动、心绞痛、心律失常、充血性心力衰竭、冠状动脉疾病、心动过缓和心动过速。传统电极是凝胶辅助的Ag/AgCl湿电极。然而,由于凝胶的粘性或水分蒸发,它们在长期使用过程中可能会刺激皮肤或遇到信号衰减。因此,在长期可穿戴应用中,通常使用可贴附皮肤的干电极。Zhang等人利用由PEDOT:PSS和水性聚氨酯(PEDOT:PSS/WPU)制成的干电极进行长期运动稳定的表皮心电图监测(图5a)。由于WPU的拉伸能力、PEDOT:PSS的导电性和D-山梨糖醇的添加,电极可以顺从地与皮肤完全接触,用于静态和动态测量,具有较低的皮肤接触阻抗和噪声。基于不同的材料和配置,还报道了具有改进的机械、物理化学或感测性能的其他可佩戴ECG传感器,例如由喷涂有AgNWs导体的多孔基底制成的电极或涂有金的PDMS基底,然后移植聚合物刷以改善皮肤接触。
5.2 光电技术
基于光电技术的PPG传感器也经常用于心率计算。随着每次心跳,含氧血液被泵入血管,脱氧血液返回,导致皮下动脉扩张和收缩。由于动脉直径和Hb与HbO2比值的变化,光吸收率随心跳而变化;因此,心率可以通过PPG信号获得。该机制的详细说明见第4.1节。目前,基于具有刚性结构和无机材料的集成电路(IC)芯片,大多数商用PPG传感器被戴在手腕上或夹在手指上。为了解决刚性问题,已经广泛提出了基于聚合物的PPG传感器,其中聚合物发光二极管(PLED)/ 有机发光二极管(OLED)和有机二极管 (OPD)都制造在塑料基板上。例如,Yokota等人展示了一种超柔性、超薄的有机光子皮肤,其具有三色(蓝、绿、红)PLEDs和OPDs以反射模式制造在1μm厚的聚对二甲苯基底上。选择基于芴、苯和其他缩聚芳香化合物的发光材料和P3HT:PCBM的光敏材料作为PLEDs和OPDs的活性材料。五个交替的SiON和聚对二甲苯层被用作钝化层,以延长在周围环境中的稳定工作时间。基于该配置,记录了稳定的PPG信号,从而可以获得心率(图5b)。
5.3 机电方法
基于机电方法的柔性可佩戴应变和压力传感器也用于胸部、手腕和颈部等位置的心率监测。由于结构简单,通常选择柔性压阻应变或压力传感器。我们小组提出了一种可拉伸的超薄压阻式光纤传感器,通过将低共熔镓铟(EGaIn)注入到PDMS制成的微管中,实现了对颈动脉、桡动脉和肱动脉等不同位置的脉搏波形的记录。进一步将注射EGaIn的微管从单腔管改进为双腔管,制成了电容式微纤维传感器,也可用于监测脉搏波形。虽然柔性压阻式和电容式传感器可用于心率监测,但它们需要依靠外部电源。或者,以自供电方式工作的柔性压电和摩擦电压力传感器已经吸引了很多关注。图5c展示了一种基于分级弹性体和塑料基板的自供电压力传感器,用于心率和其他心血管参数监测。此外,Takao Someya的小组还报道了一种基于全纳米纤维的超灵敏气体可渗透压电传感器,其显示出高达10050.6 mV·Pa-1的高灵敏度,成功实现了长期SCG信号的记录。根据这些节律脉冲或SCG波形,可根据等式(1)或FFT技术获得心率。
5.4 超声法
用于心率监测的超声波传感器依赖于对脉动动脉直径的检测。第4节详细阐述了该机制。用于心率测量的商用超声波传感器是基于多普勒的手持式超声波传感器,这种传感器是刚性的,不适合连续监测。此外,由于皮肤和刚性超声波探头之间的接触不良,信号质量容易下降。由于操作者操作的探针可能对血管产生压力,也可能对血管产生压力中断。为了解决这些问题,已经开发了超柔性超声波传感器(具有超薄PI基底和240μm的总厚度),用于获得动脉直径的脉冲波形,然后将其转换为血压(图5d)。由于与人体皮肤的自粘和共形接触,该装置可以在没有任何手动操作的情况下进行测量。因此,操作者不会引入抖动或振动引起的运动伪影。只有150毫克的重量,该设备只能在皮肤上施加3.68 Pa的压力,皮肤几乎感觉不到。因此,该设备可以执行精确和可靠的测量,而不会影响血管的脉动行为。

6 用于血氧饱和度监测的高级柔性可穿戴传感器
氧饱和度是通过血液中总血红蛋白(包括HbO2和Hb)中HbO2的比例计算的,在指示人体生理状态中起着关键作用。健康成人的正常动脉血氧饱和度(SaO2)水平在96%到98%之间。测量SaO2的一种方法是通过动脉血气测试,这需要有创抽血,并且只允许间歇测量。相比较而言,外周血氧饱和度(SpO2)是另一种有效且经常使用的参数,可用作脉搏血氧计以无创且连续的方式估计SaO2的替代参数,因为当患者的SaO2值高于90%时,它们具有仅3%差异的高度相关性。通常,使用红光(660nm)和红外光 (940nm)发光二极管,因为在红光和红外光区域的光谱中,HbO2和Hb的吸收率不同。或者,可使用绿光(530nm)代替红外光以获得更高的信噪比,据报道,可溶液处理的绿色有机发光二极管比红外有机发光二极管更稳定。根据测得的吸光度和比尔-朗伯定律,可以计算SpO2。
用于SpO2测量的柔性可穿戴血氧计已经得到广泛发展,主要包括基于光电方法的透射和反射模式。Lochner等人开发了一种透射式脉搏血氧仪(图6a ),由绿色和红色OLEDs和OPDs组成,分别以溶液处理的聚芴衍生物和PTB7:PCBM作为活性层,提供精确的血氧测量,误差为2%。然而,透射式PPG的一个缺点是,操作位置严格限制在身体的细端,如指尖、脚趾或耳垂。因此,最近的研究主要集中在柔性反射式血氧计上。Lee等人设计了一种灵活的有机脉搏血氧仪,具有反射配置,允许该设备应用于人体的各个部位,实现全天监测(图6b)。在柔性PET基底上制造,所采用的绿色和红色OLEDs基于表现出高外部量子效率的磷光发射体和有效的活性层OPD的C70与4,4′-亚环己基双[N,N-双(4-甲基苯基)苯胺] (TAPC)混合。建议的血氧计平均功耗仅为24 μW,经过校准后,SpO2监测的可行性已在身体的不同部位得到验证。
2D氧合作用图有望用于实时慢性医疗状况监测和术后康复管理,而不是测量某一点的血氧饱和度。Khan等人开发了一种灵活的有机反射血氧仪阵列(图6c ),在4.3 × 4.3 cm2的面积中有四个红色和四个近红外OLEDs和八个OPDs。对于OLEDs和OPDs,刮刀涂布的PEDOT:PSS阳极和蒸发铝阴极都在柔性PEN基底上制备。该装置显示出对SpO2测量的高精度,平均误差为1.1%,并具有2D SpO2标测能力。
利用3D打印技术,可以低成本制造定制的柔性脉搏血氧计,提供更好的一致性。Abdollahi等人开发了具有PDMS袖带的患者专用脉搏血氧计,该袖带是根据解剖扫描的模型通过自由形式可逆嵌入3D打印创建的(图6d)。定制的集成传感系统包括一个带有红色和红外发光二极管的血氧仪和用于监测心率和血氧饱和度的PD,以及其他模块,如压力传感器和柔性印刷电路板(FPCB)。在脚趾上测试了灵活的脉搏血氧计的性能,与商用脉搏血氧计相比,在休息和坐姿条件下显示了相似的SpO2和HR读数。然而,由于行走引起的运动伪影,PPG信号在行走期间是不稳定的。
为了进一步减小灵活的脉搏血氧仪的尺寸和功耗,Han等人使用环境光代替LEDs作为光源。柔性OPD印刷在PEN基底上,并覆盖有光谱过滤器,用于特定波长的光强度检测。此外,通过近场通信(NFC),开发了一种应用于指甲上的柔性脉搏血氧仪,其具有小型化的免电池配置。尽管具有舒适性和舒适性的优势,但必须解决更稳定的操作和消除运动伪影的问题,以促进柔性血氧计的临床应用。

7 用于连续血压监测的高级柔性可穿戴传感器
血压是循环血液对动脉血管壁施加的压力,通常表示为两个重要参数,收缩压(SBP)和舒张压(DBP)。对于健康人来说,SBP/DBP值约为120/80 mmHg,而异常高的血压被认为是高血压,是心血管疾病的一个重要危险因素。传统的动脉血压监测器基于示波法,需要在手臂上安装一个大体积的可充气袖带,并且仅提供间歇测量。然而,一些高血压引起的疾病直到在人体内发生严重损害时才表现出明确的症状,这就提出了对连续血压监测的需求,为早期疾病干预和治疗提供了机会。此外,与刚性血压监测器相比,柔性连续血压监测器更贴合皮肤,为不显眼的监测提供更舒适的体验。一般来说,BP可以通过PTT、PAT、超声和机器学习技术进行连续监测。
7.1 PAT技术
基于PAT的血压监测技术包括监测心电信号的ECG传感器和记录脉搏波机械活动的PPG/BCG/SCG/压力传感器。Xu等人利用无机近红外LED和高灵敏度有机光电晶体管(OPT,3.5×105 A·w-1)开发了一种柔性PPG传感器(图7a)。OPT主要由60 nm氧化铝/氧化硅(Al2O3/SiO2)双层电介质(实现3 V的低工作电压)和80 nm厚的DPP-DTT:PCBM层(充当光活性材料)制成。为了证明连续血压监测的准确性,将建议的柔性PPG传感器和基于商业袖带的PPG传感器安装在不同的指尖上,以记录外周脉搏波,同时将ECG传感器放置在前臂上,以记录ECG信号以及用于提取PAT的PPG信号。对于SBP和DBP读数,柔性装置和商用装置之间的平均绝对差值小于5 mmHg。Fan等人开发了一种可穿戴式液囊压阻式压力传感器(LCPS),具有高线性度(0–50 kPa)、最小迟滞、高稳定性(>30000次循环)和低功耗(35nW)(图7b)。压阻碳黑装饰的织物层浸涂在叉指电极上,并用PEN膜覆盖。然后将传感器嵌入充满甘油的硅酮弹性体胶囊中。基于帕斯卡原理,脉冲信号通过液体传输到传感器,降低了对传感器校准的严格要求,公差为±8.5mm。将LCPS测量的脉搏信号和心电信号结合进行基于PAT的搏动血压监测,与PPG/ECG得出的结果相比,SBP和DBP的平均绝对差值小于3 mmHg。虽然通过参考心电图R波更容易获得PAT,但射血前期(PEP)的存在为基于PAT的血压估计增加了一个额外的变量,因为它很容易因各种原因而改变,如压力、情绪、年龄和体力。将PEP纳入考虑范围可以使血压监测系统更加准确。
7.2 PTT技术
PTT是指脉搏波在两个动脉点之间传播的时间间隔,可以从检测到的PPG、BCG、SCG或压力信号等计算出来,已广泛用于基于各种数学模型的连续BP估计。然而,用于记录上述信号的传感器易受运动伪影的影响。人们已经尝试了不同的方法来解决这个问题,例如改善一致性、运动暂停、使用差分信号等。Li等人开发了一种类似皮肤的双通道光电器件,用于连续血压监测(图7c),超薄无机红外(850nm,GaAs基),红光(620nm,GaAs基)和绿光(515nm, Al2O3基)发光二极管在中间,四个二极管(400-1100nm,硅基)放置在LEDs两侧,从两个PPG信号获得PTT。互连以表链形状形成图案,呈现低电阻和拉伸性。使用50μm厚的生物相容性薄膜封装,这种薄而柔韧的装置仅通过范德华相互作用与皮肤共形。通过假设运动伪影对每个PPG信号的影响相似,检测到的绿光和红光/红外光强度之间的差异可以有效地抑制运动伪影。在静态和步行状态下测试绝对DBP/SBP误差,分别为±7/±10和±10/±14 mmHg。
能够检测动脉脉搏的压力传感器也可以用于提取PTT以进行连续血压监测。Jin等人开发了一种低成本的柔性温度和力传感器,仅使用两根碳纤维梁,放置在1cm2的FPCB衬底上,用PI薄膜封装,其中碳纤维充当热和机械传感有源元件。图7d中所示的交叉结能够感知力,最小感测力为3 mN,灵敏度为0.66 kPa-1。四个传感器被放置在不同的身体部位,以测量血压、心率、体温和呼吸频率。从记录在左颈动脉和左食指上的两个脉搏波中提取PTT,并且随后可以计算血压。
7.3 机器学习技术
利用多个因子估计BP有望提高精度,实现无标定BP计算。基于机器学习的技术的主要目的是从PPG的时域和频域提取与BP相关的多个特征,ECG或生物力学信号,然后使用机器学习从训练的数据计算BP。通常用于连续血压监测的机器学习算法包括但不限于线性回归、神经网络、支持向量机、随机森林和深度学习。
基于PTT/PAT的BP监测器需要两个传感器一起工作来记录两个同步信号,用于PTT/PAT提取。然而,ML算法仅使用一个传感器就可以基于从一个信号中选择的多个特征进行准确的BP估计,这减小了监测系统的尺寸并提高了耐磨性。举个例子,Huang等人开发了一种柔性压力传感阵列,由聚对二甲苯 C衬底和导电聚合物薄膜组成,具有微面结构以提高灵敏度(-0.533kPa-1)。从脉搏波中选择11个特征,80%的数据用于训练三种采用的机器学习算法。结果表明,随机森林算法给出了比梯度增强回归和自适应增强回归更好的性能,对于SBP和DBP,估计的和基于袖带的参考BP之间的系数R2分别为0.871和0.794。
7.4 超声波技术
中心血压(CBP)波形比外周血压(PBP)波形传达更多有关心血管疾病的信息,因为心脏、大脑和肾脏直接暴露于中心动脉。因此,以CBP为基础的医学指示比PBP更可靠。然而,中央动脉通常埋在皮肤下3cm深的地方,在那里CBP信号不能被安装在皮肤上的光学PPG传感器或压力传感器捕获。由于超声波在人体组织中穿透很深,柔性超声波传感器有希望连续记录CBP信息。Wang等人开发了一种240μm厚的柔性超声设备,该设备由一个4 × 5阵列的刚性1–3复合压电柱组成,可自动映射血管的位置,并在PI基底上设置铜电极,以提供60%的拉伸性(图7e)。该设备通过范德华力在不同身体部位和不同姿势下与人体皮肤稳定贴合,显示出比商用张力测定计更强的血压监测能力。校准后用商业张力测定计评估CBP读数的准确性,显示收缩压和重搏切迹的差异分别为0.05和0.28 mmHg。Peng等人开发了可弯曲超声波血压传感器,由基于银纳米线的可拉伸电极和压电1–3复合结构组成,PZT-5A作为活性材料,周围是PDMS填料(图7f)。根据发射和接收的超声信号,检测血管直径的变化并转换成血压。使用商用上臂血压监测器对所提出的传感器进行了测试,显示了一致的结果。

8 用于血糖监测的高级柔性可穿戴传感器
糖尿病是最臭名昭著的慢性疾病之一,主要由免疫系统功能障碍或代谢疾病引起,导致血浆中积累过量的葡萄糖。长期异常的血糖浓度可诱发严重的CVD相关并发症,如高血压、血脂异常、糖尿病性心肌病、心血管自主神经病变和心肌梗死,这些被认为是糖尿病患者发病和死亡的最普遍原因。考虑到糖尿病的破坏性后果和激增的趋势,监测和调节血糖水平对于预防其流行和预防长期CVD并发症的风险至关重要。尽管从血样中评估血糖的传统方法被广泛使用,但是这种侵入性测试过程是不舒服的,并且不能为患者提供连续的监测。因此,介绍了许多其他替代的非侵入性或微创血糖检测原理,例如电化学方法、光学方法和微波方法等。其中,电化学分析诸如汗液、唾液、泪液和ISF等生物流体中的葡萄糖浓度是实现连续监测能力的最有前途的方法。由于其具有相对简单的工作机制和可穿戴的检测布局,因此引起了广泛的研究兴趣。
8.1 基于汗液的可穿戴传感器
由于汗液富含生化标记物并且易于被表皮传感器获取,因此汗液对于健康监测是一种有吸引力的生物流体。在汗液中发现了葡萄糖等小分子,其浓度与血液中的浓度相关。然而,由于各种干扰因素,如皮肤温度和pH值、周围环境污染物(包括葡萄糖和其他生物标志物)、汗液中的葡萄糖浓度低(通常为20–600×106M)、样本量小以及汗液蒸发,精确测量汗液中的葡萄糖浓度并不容易。为了克服这些困难和缺点,需要一个具有多种监测功能的集成系统、具有高灵敏度/选择性的葡萄糖传感器以及合适的样品摄取和运输方法。鉴于最近在柔性材料、制造技术和传感方法方面的进展,已经提出了几种有前途的平台来实现连续的血糖监测。
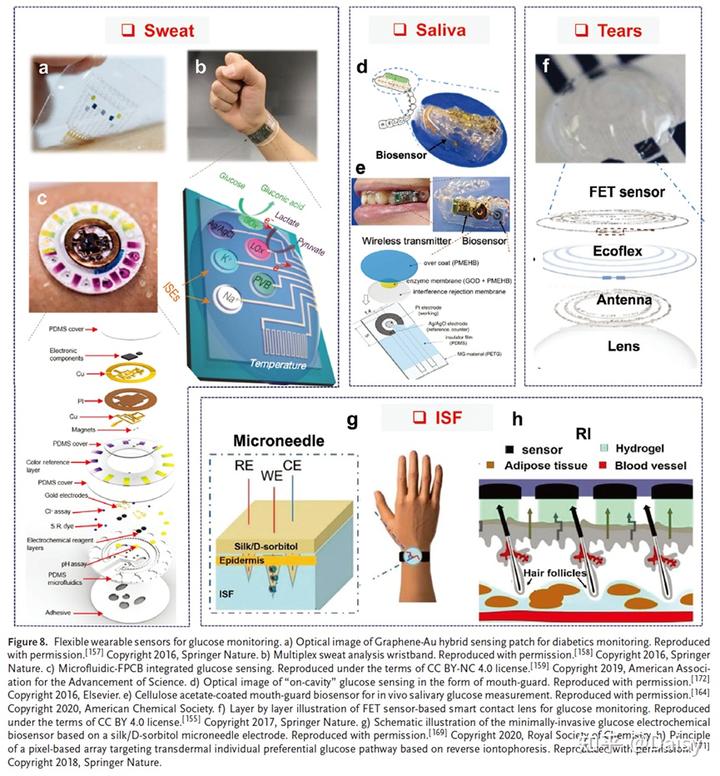
为了监测葡萄糖浓度以及其他干扰因素(pH值、温度和湿度),Lee等人最近开发了一种柔性贴片,由基于金/金掺杂石墨烯蛇形双层的多个传感器和热响应微针阵列组成,作为热诱导药物递送单元。该贴片利用柔软、有弹性的硅树脂作为基底,以最大限度地提高耐磨性,利用葡萄糖氧化酶/普鲁士蓝复合材料作为传感活性层,利用金掺杂石墨烯和金蛇形线的混合双层作为电极层,并通过互连实现良好的拉伸性(图8a)。石墨烯-金杂化层由于其大的活性表面和酶与电极之间的电转移效率导致的增强的性能而在灵敏度上显示出优势。此外,原位pH和温度被同时监控,因为它们干扰葡萄糖的测量。基于所获得的数据,实时葡萄糖浓度被校正,导致类似于商业葡萄糖检测试剂盒的高监测准确度。除了使用锥贴片作为需要额外的信号收集/传输单元的灵活平台之外,Gao等人最近报道了基于的完全集成的电化学传感器阵列。采用腕带的形式,该系统能够连续监测汗液中的多种离子和代谢物,包括葡萄糖和乳糖酶(图8b)。为了进一步提高佩戴性,Bandodkar等人设计了双层FPCB和一次性微流体通道的混合系统,能够实现无电池、无线和多功能的汗液分析(图8c)。这种系统利用类似生物燃料的传感器来简化电路并实现无线供电,使该系统比前面提到的工作轻约20倍。此外,还报道了一种使用碳化丝绸织物的透气集成纺织传感器贴片,用于实时和多种汗液分析,包括葡萄糖监测。
8.2 基于唾液的可穿戴传感器
唾液是一种容易获得的生物流体,也由几种重要的生物标志物组成,包括免疫球蛋白G/A、葡萄糖和微生物组。这些生物标志物不仅可以提供口腔状况的信息,还能洞察整体健康状况。由于健康成年人产生大量唾液(大约每天1升),这使得唾液成为连续葡萄糖监测的潜在对象。唾液中的葡萄糖浓度,尽管仍有争议,但被发现与血液中的葡萄糖浓度有很强的相关性。然而,体内监测唾液葡萄糖并不像看起来那么容易。口腔环境的复杂性,包括细菌及其代谢产物,自动pH变化和来自食物和饮料的污染是获得准确读数的主要障碍。此外,直接和连续收集唾液需要口腔内装置,这要求装置具有更好的生物相容性和稳定性。Arakawa等人最近报道了一种护口器生物传感器,它为连续唾液葡萄糖监测提供了一种潜在的方法(图8d)。该传感器采用传统形式的电化学葡萄糖传感器,具有聚(MPC-co-EHMA)/GOx复合物作为酶膜。传感和无线传输单元由聚对苯二甲酸乙二醇酯(PETG)薄膜封装,然后与牙齿护口器集成在一起。使用人工唾液的实验表明,响应电流与动态葡萄糖浓度(从1到1000×10-6M)密切相关(R = 0.999)。当放入模拟口腔条件的幻颚时,获得了长期稳定性的类似结果。然而,已经发现唾液的污染是一个问题,并且在上述研究中,生物传感器还没有在人的口腔中实施。为了解决这个问题,他们利用醋酸纤维素膜来抑制唾液中抗坏血酸和尿酸的干扰。由于乙酸酯基团的静电排斥和尺寸效应,污染物的性能受到抑制,并且在没有对人唾液进行任何预处理的情况下成功地在体内测量了葡萄糖浓度(图8e)。
8.3 基于眼泪的可穿戴传感器
人的眼泪通常含有20多种不同的成分,包括葡萄糖、蛋白质和其他代谢物,是另一种新兴的用于医疗监控应用的生物流体。几项研究表明,泪液葡萄糖水平(大约0.05–5×10-3×10-3M)与血清葡萄糖水平之间存在良好的相关性。然而,对于体内葡萄糖测量,泪液样本收集、装置制造和时间分辨率方面的挑战仍有待解决。尽管这些困难还没有被完全克服,但智能隐形眼镜形式的一些有前途的平台展示了精确泪液葡萄糖监测的潜在方法。例如,Kim等人最近设计了一种基于石墨烯-银纳米线的场效应晶体管(FET)设备,用于被动测量眼泪中的葡萄糖浓度(图8f)。石墨烯/银纳米线 (Gr/AgNW)杂化物由于其优异的光学透明度、低电阻和高拉伸性而被特别选择。传感元件的特点是采用GOx功能化石墨烯作为通道的FET传感器和由Gr/AgNW 混合制造的用于无线读出的天线。聚对二甲苯由于其可观的机械拉伸性、无针孔沉积和良好的生物相容性而被选为基底。体外和体内实验均表明了FET传感器定量检测兔泪液中葡萄糖浓度变化的可行性和长期稳定性。为了进一步定量测量泪液葡萄糖水平并集成按需治疗模块,Keum等人最近报道了一种用于糖尿病检测和治疗的具有葡萄糖生物传感器和灵活药物输送系统的电化学接触镜。该系统将柔性超薄电路与专用集成电路微控制器芯片和硅水凝胶基底相结合,以提供传输/控制的可穿戴性和无线性。体外实验显示了该生物传感器的高灵敏度(0.42 uA/5mg dl-1)、线性和长期稳定性(63天后偏差小于2%)。对佩戴隐形眼镜的糖尿病兔进行进一步评估,以证明该设备在连续葡萄糖监测和糖尿病视网膜病变的按需治疗方面的可行性。
8.4 基于组织液的可穿戴传感器
尽管上述基于汗液、泪液和唾液分析物的葡萄糖监测装置显示出非凡的优势,但是介质中葡萄糖的低浓度和复杂、易变的监测环境会影响其准确性和稳定性。或者,包含最接近血液葡萄糖浓度的ISF已被视为可靠和准确的工具。为了收集ISF,广泛使用两种微创方法——微针和反向离子透入技术。
微针葡萄糖监测装置是提取ISF最有效的技术,可以直接穿透角质层,以轻微的损伤和疼痛进入ISF。为了优化微针葡萄糖监测的稳定性,Zhao等人演示了一种基于微针的电化学生物传感器,用于连续葡萄糖监测(图8g)。该装置由三个电极组成,这三个电极由整合了铂(Pt)和Ag线的丝/D-山梨醇金字塔微针制成,其中工作电极通过将选择性葡萄糖酶(GOx)固定在整合了Pt线的微针中来实现功能化。蚕丝/D-山梨醇独特的亲水和疏水结构为酶分子提供了稳定和生物相容的环境,可以保护酶免受温度和水分的影响,因此具有高稳定性,在连续监测24小时后,响应下降不到7%。
尽管用于连续葡萄糖检测的新型微针设计有各种优点,但是它仍然需要针的微创注射来接近皮下层中的ISF。为了优化用户友好的性能,已经研究了反向离子电渗技术,该技术可以通过在皮肤上施加低电场以触发电渗流来提取ISF。基于集成在柔性基板上的微型像素设备阵列和铂修饰的石墨烯工作电极,Lipani等人设计了一种路径选择性、非侵入性、经皮葡萄糖监测系统。该传感平台的特点是具有固定面积和体积的精心设计的小型化酶包裹凝胶储库像素阵列,能够根据提取的葡萄糖的恒定稀释系数以及凝胶内和皮下葡萄糖浓度之间的关系,对经皮葡萄糖进行免校准检测。充分优化密集像素阵列确保每个单独的像素可以询问至少一个优选路径,并且可以询问这些路径的冗余,以实现精确的免校准定量(图8h)。此外,采用柔性PET片作为功能基板,实现了像素阵列结构的血糖监测,使整个监测系统具有很高的灵活性和耐磨性。
9 挑战和未来展望
柔性可穿戴传感器的最新突破为连续心血管监测带来了光明的应用前景,尤其是在心血管疾病的早期检测和预防方面。通过向用户授权其健康状况,用户可以主动采取措施来改善其健康状况。即便如此,仍然存在许多挑战和机遇。这里,我们描述一些技术限制,如图9所示。
9.1 在运动、长期使用或极端条件下,信号会变差
大多数设备都需要与皮肤贴合,以实现可靠的信号记录。例如,心电图传感器需要与皮肤紧密接触,以最大限度地降低接触阻抗和噪声。需要机械传感器与皮肤紧密接触,以检测动脉或心脏的细微振动。特别地,在用于脉搏监测的基于眼压测量的机电传感器中也需要外部压力。在光电传感器的情况下,接触不良不仅会产生运动假象,还会引起光干涉。然而,在运动过程中,由于皮肤和装置的杨氏模量不匹配,以及它们之间的低粘附性,经常发生滑动和脱离。为了克服这个问题,提出了自粘超薄传感器,通过范德华力或化学粘附实现与皮肤的柔顺接触。然而,在长期运动或极端条件下,如水下条件下,附着的稳健性仍然是一个挑战。仍然需要考虑刺激性和高粘附性之间的权衡。因此,可以在运动、长期使用或极端条件下可靠监测心血管生命体征的未来柔性可穿戴传感器备受期待。
9.2 无线数据传输、信号采集和处理以及供电的局限性
无线数据通信促进了实时监控能力和超越临床或固定位置使用的便携性。然而,通信模块是能量密集型的。例如,当前的蓝牙技术通常消耗约5mW的功率,即使是低功率小型化蓝牙也需要至少1mW的功率,这超出了大多数薄膜电池的当前能力(< 1mW)。因此,系统中需要额外的能量储存。为了解决这一限制,纳米发电机用于收集日常生活中的生物力学能量,为这些传感器提供动力已提议。然而,这种能量仍然不足以为整个系统提供动力。另一种选择是使用基于感应共振能量转移的无线充电或供电技术。特别是,由于NFC天线具有供电和数据通信的双重功能,无需依靠外部电池,因此得到了广泛的开发和利用。尽管如此,传输距离和采样频率是有限的。此外,信号采集和处理模块以及无线数据传输通常基于商用刚性IC芯片,使得整个系统体积庞大且灵活性较差。因此,在未来用于心血管生命体征监测的柔性可穿戴生物医学传感器中,需要探索更先进的信号采集、信号处理、数据传输和供电策略。
9.3 医学诊断的局限性
尽管柔性可穿戴生物传感器已广泛用于心血管生命体征监测,但基于大数据和深度学习的诊断能力仍未得到充分发展。例如,大多数现有的生物电或机电传感器仅呈现ECG信号或HR参数,而没有专业的医学解释,这对于用户来说是无意义的,并且远离临床医生对心脏相关疾病的医学诊断。期望提取更深刻的参数,例如心率变异性和心输出量以及其他相关的多个参数,这些参数可以导致高精度的综合医疗诊断。因此,具有多种心血管生命体征监测功能和集成人工智能算法的灵活可穿戴传感器有望实现精确和全面的诊断。

10 结论
与用于预测或诊断心血管疾病的传统刚性传感器不同,柔性传感器在便携性、舒适性、低成本和方便使用方面具有无可比拟的优势,因此非常适合于可穿戴式心血管生命体征监测。在这篇综述中,我们展示和讨论了先进的柔性可穿戴传感器,用于无创实时监测心血管生命体征,包括心率、血压、血氧饱和度和血糖,重点讨论了有效获取与心血管疾病相关的可靠生物信号的材料、机制和设备配置。我们希望这篇综述能让读者了解先进的柔性功能材料、基本的传感原理以及这些传感器的结构。我们相信,随着柔性传感器、物联网、供电设备、数据通信技术和其他相关技术的进一步改进,可穿戴生物医学系统在心血管生命体征监测和处理心血管疾病以进行实际临床诊断以及提供个性化医疗保健方面将大有可为。
亲爱的,谢谢你能看到最后。
如果你喜欢我的分享,请点赞、喜欢或收藏。
如果你希望了解更多关于柔性电子的顶刊论文,请关注我,我会坚持分享。
如果你想全面了解这篇论文的内容,请私聊我。
- 原文作者:知识铺
- 原文链接:https://index.zshipu.com/ecg/post/20240419/%E7%94%A8%E4%BA%8E%E5%BF%83%E8%A1%80%E7%AE%A1%E7%94%9F%E5%91%BD%E4%BD%93%E5%BE%81%E7%9B%91%E6%B5%8B%E7%9A%84%E6%9F%94%E6%80%A7%E5%8F%AF%E7%A9%BF%E6%88%B4%E4%BC%A0%E6%84%9F%E5%99%A8--%E7%9F%A5%E8%AF%86%E9%93%BA/
- 版权声明:本作品采用知识共享署名-非商业性使用-禁止演绎 4.0 国际许可协议进行许可,非商业转载请注明出处(作者,原文链接),商业转载请联系作者获得授权。
- 免责声明:本页面内容均来源于站内编辑发布,部分信息来源互联网,并不意味着本站赞同其观点或者证实其内容的真实性,如涉及版权等问题,请立即联系客服进行更改或删除,保证您的合法权益。转载请注明来源,欢迎对文章中的引用来源进行考证,欢迎指出任何有错误或不够清晰的表达。也可以邮件至 sblig@126.com